76. 용어(생물학적 제제 등 제조 지원 설비의 검증 및 유지 관리 등에 관한 가이드 라인)정제수 또는 주사용 증류수 같은 최종 처리 단계의 공급 수로서 요구되는 품질 규격을 충족시키기 위해서 수돗물 또는 우물물이 복수의 공정 단계 또는 단위 공정을 통해서 변경되는 일련의 과정 중 용수를 의미한다.정답:② 전 처리 수 77. 용어(생물학적 제제 등 제조 지원 설비 검증 및 유지 관리 등에 관한 가이드 라인)설비 및 기기, 시스템이 사용자 요구 규격에 부합하도록 만들기 위해서 필요한 규격으로, 일반적으로 전체 시스템 및 각 부품의 구조 도면 용량, 엔지니어링·엔지니어링·설계.정답:③ DS78)운전 적격성 평가에 포함되는 사항(생물학적 제제 등 제조 지원 설비의 검증 및 유지 관리 등에 관한 가이드 라인)정답:①번 재질 성적서 → 계측기 교정 및 교정 유효성 확인

79. 제조용수 및 청정증기 품질규격(생물학적 제제 등 제조지원설비의 바리데이션 및 유지관리 등에 관한 가이드라인) 정답: ② 총유기탄소는 주사용수의 경우 500ppb 이상이어야 한다. → 이하여야 한다.
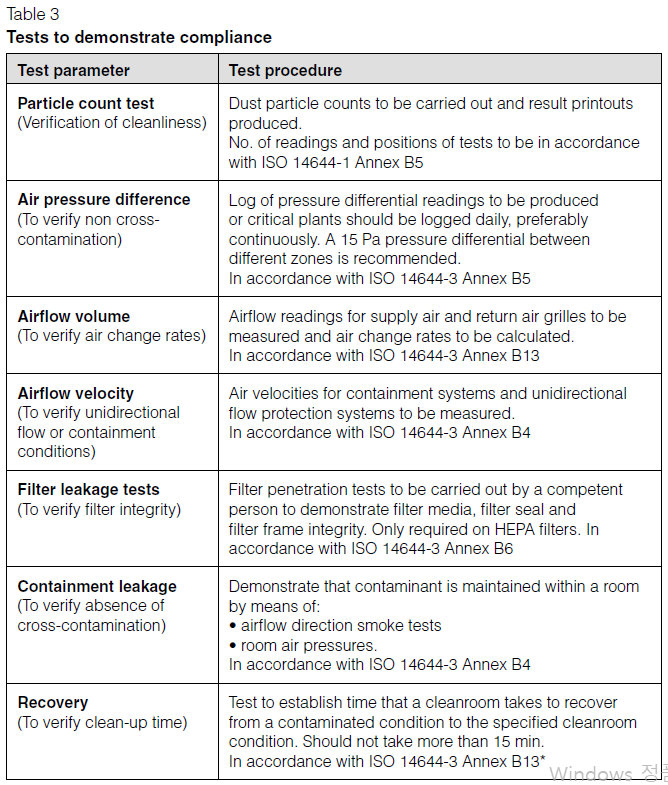
제조용수 및 청정증기 품질규격

※ GMP교육아카데미교재오류참고

http://www.bvc.co.kr/sub6/1.php?flag=view&aid=&bid=1&cate=0&num=10013&retURL=%2Fsub6%2F1.php

한국GMP아카데미_공지[2022년 교재 오류사항 공지] 안녕하세요, GMP 협회입니다. 2022년 개정 후 출고된 교재에서 오류사항이 발견되어 공유드립니다. 추후에 다른 오류가 발생할 경우 해당 글로 추가 업데이트 할 예정이오니 참고 부탁드립니다.업무에 혼란을 드려 죄송합니다. 교재 오류는 아래 내용을 참고하시기 바랍니다. ______1. Part 3 / Page149 – 토출구층면적(X), 토출… www.bvc.co.kr

80. 가스 시스템·검증 설치 적격성 평가(생물학적 제제 등 제조 지원 설비·검증 및 유지 관리 등에 관한 가이드 라인)정답:④번 계측기 교정 → 재질 성적서 81. 전 처리 시스템 연수 장치(생물학적 제제 등 제조 지원 설비의 검증 및 유지 관리 등에 관한 가이드 라인)정답:①번 역 침투막, 탈염 칼럼과 증류 장치와 같은 후속 장치의 성능을 가로막는 칼슘과 마그네슘 같은 음이온을 → 양 이온을 제거하기 위해서 연수 장치를 사용한다.82. 그 다른 용수 품질 유지를 위한 추가 구성 요소(생물학적 제제 등 제조 지원 설비 검증 및 유지 관리 등에 관한 가이드 라인)정답:②번 사용 지점에서는 오존이 존재해서는 안 되며, 그래서 240nm의 → 254nm의 자외선이 사용된다.83. 압축 공기 시스템의 운전 적격성 평가(생물학적 제제 등 제조 지원 설비 검증 및 유지 관리 등에 관한 가이드 라인)정답:④번 중요 부품 설치 확인 → 교정 확인

84. 의약품 제제 및 사용용수(제조지원설비 등 바리데이션 프로토콜) 정답:①번 원료약품 제조에는 정제수만 → 상수 또는 정제수를 사용한다.85. 공조시스템 성능에 대한 검증기간 및 주기(제조지원설비 등 바리데이션 프로토콜) 정답:③번 PhaseⅡ단계에서는 PhaseⅠ단계에서 실시한 결과를 토대로 평가결과에 적합할 경우 최악조건에 해당하는 위치를 포함한 측정위치를 재조정하고 1주일 이내 간격으로 재평가한다. 연속 4주 측정한 자료에 문제가 없을 경우 2주 이내 간격으로 8주→12주 실시하고, 연속 8주→12주 측정자료에 문제가 없을 경우 4주 이내 8주 실시하며, 문제가 없을 경우 PhaseⅢ 단계로 넘어간다.
86. 제조소(완성의약품 가이던스, 55p) 정답:②번 물리적 격리를 대체하는 모든 시스템은 순차적으로 →동등한 보안성을 제공해야 한다.https://slidesplayer.org/slide/14875046/90/images/5/%EC%A0%81%EA%B2%A9%EC%84%B1%ED%8F%89%EA%B0%80+%EC%84%A4%EC%B9%98%EC%A0%81%EA%B2%A9%EC%84%B1%ED%8F%89%EA%B0%80%28Installation+Qualification%29.jpg87. 제제군별 완성의약품 약전제형 분류 (완제의약품 가이던스, 505p) 정답 : ④번외용액제→내용액제-유제88. 방충방서시설(완성의약품 가이던스, 514p) 정답:③번 방충방서설비는 혐오시설이므로 그 설치장소를 도면에 표시하여 관리하는 것은 바람직하지 않다. → 관리하는 것이 바람직하다.89. 화장실, 탈의실 및 수세시설(완제의약품 가이던스, 516p) 정답: ②번 갱의실은 제품의 특성, 제조방법을 고려하여 적절히 설치하여야 한다. 청정관리지역 내에서 청정도가 높은 지역에 출입하기 위해 추가 탈의를 할 수 있다.90. 시험실(완성의약품 가이던스, 514p) 정답:②번 생물학적 검체 또는 방사성 검체와 같은 특정 물질을 취급하는 시험실은 관련 규정이 있을 경우 별도 요건이 필요 없다. → 필요하다. 91. 작업소 시설(완제의약품 지침, 524p) 정답: ③번 공조 시스템이 단일 제품 시설에 존재하고 교차 오염이 발생하지 않는다는 증거가 있는 경우에도 HEPA 필터는 필요하다. → 필요하지 않은 경우도 있다.92. 용수 시스템의 바리데이션 기간(제조 지원 설비 등 바리데이션 프로토콜)이. Phase I, II에서는 (2-4)주간 실시한다. B. Phase III에서는 (11)개월 이상 실시한다.정답:④2-4,1193. 생물체의 생물학적 안전성(Bio-Safety) (생물학적 제제 제조·품질관리 생물안전 가이드라인) 정답 : ① 제1위험군 : 건강한 성인에게는 질병을 일으키지 않는다고 여겨지는 생물체 ※생물안전위험군 분류기준93. 생물체의 생물학적 안전성(Bio-Safety) (생물학적 제제 제조·품질관리 생물안전 가이드라인) 정답 : ① 제1위험군 : 건강한 성인에게는 질병을 일으키지 않는다고 여겨지는 생물체 ※생물안전위험군 분류기준94. 소프트웨어 카테고리별 컴퓨터 시스템 접속 방법(완제의약품 지침, 524p) 정답: ①번 기반 소프트웨어→비구성 제품: 사용 목적에 맞게 소프트웨어를 구성할 수 없음※ 2번도 구성 제품이 아닌 비구성 제품에 대한 설명이므로 틀린 것 같지만 교재 오류 공지에는 없으므로 확실하지 않습니다.단순히 참고해주세요!※ 【표 1】컴퓨터 시스템 (소프트웨어) 카테고리별 관리 접근법 [출처 : PICK/sPI011-3 및 ISPE GAMP]95. 컴퓨터화 시스템(완성 의약품 가이던스, 560p)정답:④번 컴퓨터화 시스템의 운영 환경은 네트워크와 같은 물리적 환경 외에 해당 컴퓨터화 시스템을 운영하는 조직 등의 인적 환경 또는 규제 환경도 포함되지 않는다. → 있다. 96. 사용자 요구 규격서(URS)(완성 의약품 가이던스, 576p)정답:②번 사용자 요구 규격서(URS)에는 대상 시스템 자체의 기능적 측면의 요구 사항 외, 운용 효과, 유지 보수 쉽등 비기능적 측면 요구 사항도 포함되지 않는다. → 있다. 97. 데이터 완전성의 주요 요건(ALCOA)(완성 의약품 가이던스, 591p)정답:② 번식 안 또는 전자적 방법으로 읽기 어렵지 않으면 안 된다. → 쉽지 않으면 안 된다.데이터 무결성의 주요 요건(ALCOA)98. 부유입자측정 ISO 14644-1(생물학적 제제 등 제조지원설비의 바리데이션 및 유지관리 등에 관한 가이드라인, 본 2권 100p) 정답:①번 일부 구역을 세분화할 경우 그 구역에서 추가적인 샘플링 위치를 선택할 수 없다. → 있다.99. 적용 범위(21 CFR Part 11-Electronic Records;Electronic Signatures, 책 2권 223p)정답:③번 종이 기록 서가 구체적으로 요구되는 경우가 아니면 이 파트의 기준에 부합하는 전자 기록증을 11.2에 근거하여 종이 기록소 대신 사용할 수 없다. → 있다. 100. 용어(21 CFR Part 11-Electronic Records;Electronic Signatures, 책 2권 224p)컴퓨터 시스템이 생성 변형, 유지, 보관, 검색 또는 유포하는 디지털 방식의 텍스트, 그래픽 데이터, 오디오, 그림 또는 기타 정보 표현물의 조합을 의미한다.정답:①번